
- Tác giả Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:42.
- Sửa đổi lần cuối 2025-01-22 17:13.
Bari hydroxit có thể được chuẩn bị bằng cách hòa tan oxit bari (BaO) trong nước: BaO + 9 H2O → Ba (OH)2·8 GIỜ2O. Nó kết tinh dưới dạng octahydrat, chuyển đổi thành monohydrat khi đun nóng trong không khí. Ở 100 ° C trong chân không, monohydrat sẽ tạo ra BaO và nước.
Về điều này, điện tích của bari hydroxit là gì?
Giải trình: Bari là một nguyên tố trong Nhóm 2, vì vậy nó có hai điện tử hóa trị và sạc điện là 2+. Hydroxit là một ion âm đa nguyên tử có hóa trị 1 và sạc điện là 1-. Như bari là một kim loại trong khi hydroxit là một phi kim loại, chúng kết hợp với nhau để tạo thành một hợp chất ion.
Tương tự, bari hiđroxit có tan trong nước không? Nước
Tương tự như vậy, người ta hỏi, bari hiđroxit có tạo thành kết tủa không?
Phần lớn thời gian, một màu trắng mờ nhạt kết tủa của bari hydroxit được hình thành. Bari hydroxit ít tan trong nước và có thể tạo ra dung dịch có nồng độ khoảng 0,1 M ở nhiệt độ phòng; bari hydroxit trên 0,1 M sẽ không tan.
Bari hydroxit phân ly như thế nào?
(1) Bari hydroxit phân ly hoàn toàn trong nước để sản xuất bari ion và ion hydroxyl: {eq} Ba (OH) _2 (s) ightarrow Ba ^ {2+} (aq) +
Đề xuất:
Các sản phẩm trong phương trình phân tử cho phản ứng trung hòa hoàn toàn của bari hydroxit trong nước và axit nitric là gì?

Ba (OH) 2 + 2HNO3 → Ba (NO3) 2 + 2H2O. Bari hydroxit phản ứng với axit nitric tạo ra bari nitrat và nước
Làm thế nào để bạn tính toán điện thế rơi trong một mạch?
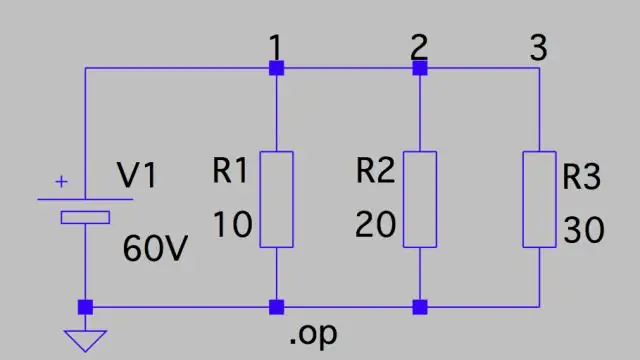
Giảm điện áp: Mạch song song Điều này có nghĩa là điện áp giảm trên mỗi mạch chỉ là tổng điện áp của mạch chia cho số điện trở trong mạch, hoặc 24 V / 3 = 8 V
Làm thế nào để bạn tính toán ước tính khoảng thời gian?

Đối với cỡ mẫu (n). và chia nó cho căn bậc hai của n. Tính toán này cung cấp cho bạn biên độ sai số. Thống kê cho hình nộm, phiên bản thứ 2. Mức độ tin cậy z * -value 90% 1.645 (theo quy ước) 95% 1.96 98% 2.33 99% 2.58
Làm thế nào để bạn tính toán ngoại thất thay thế?

Để tìm các góc bên ngoài, hãy nhìn vào không gian bên trên và bên dưới các đường chéo. Để tìm các góc bên ngoài thay thế, hãy nhìn vào không gian bên ngoài đó cho từng đường chéo, ở các mặt khác nhau của đường ngang. Chúng tôi hy vọng bạn đã nói ∠ 1, ∠ 2, ∠ 7 và ∠ 8 là các góc bên ngoài
Làm thế nào để bạn tính toán độ tinh khiết phần trăm?
% độ tinh khiết = g chất tinh khiết thu được ÷ gof mẫu đã cho × 100. Phần trăm độ tinh khiết của một chất có thể được tính bằng cách chia khối lượng của hóa chất tinh khiết cho tổng khối lượng của mẫu, rồi nhân số này với 100
