
- Tác giả Miles Stephen [email protected].
- Public 2023-12-15 23:42.
- Sửa đổi lần cuối 2025-01-22 17:13.
Răng hàm nồng độ của các ion hydro hòa tan trong dung dịch là thước đo độ axit. Càng lớn nồng độ , độ chua càng lớn. Cái này nồng độ có thể nằm trong một phạm vi lớn, từ 10 ^ -1 đến 10 ^ -14. Vì vậy, một cách thuận tiện để thu nhỏ phạm vi này là NS quy mô có nghĩa là sức mạnh của hydro.
Tương tự, bạn có thể hỏi, nồng độ H + ảnh hưởng đến độ pH như thế nào?
Càng cao thì Nồng độ H + , càng thấp thì NS , và OH- càng cao nồng độ , càng cao thì NS . Tại một trung lập NS trong số 7 (nước tinh khiết), nồng độ của cả hai H + ion và ion OH- là 10? 7 M. Do ảnh hưởng này, H + và OH- liên quan đến các định nghĩa cơ bản của axit và bazơ.
Ngoài ra, nồng độ liên quan đến độ pH như thế nào? Tổng thể nồng độ của ion hydro là tỷ lệ nghịch có liên quan đến nó NS và có thể được đo lường trên NS thang đo (Hình 1). Do đó, càng có nhiều ion hydro, thì NS ; ngược lại, càng ít ion hydro, thì NS.
Mọi người cũng hỏi, làm cách nào để chuyển đổi pH sang nồng độ H +?
Các NS của một nghiệm bằng logarit cơ số 10 của Nồng độ H + , nhân với -1. Nếu bạn biết NS của một dung dịch nước, bạn có thể sử dụng công thức này ngược lại để tìm ra hàm số sai và tính toán Nồng độ H + trong giải pháp đó. Các nhà khoa học sử dụng NS để đo mức độ axit hoặc bazơ của nước.
Sự khác biệt về nồng độ H + đối với mỗi đơn vị pH là gì?
Nồng độ ion hydro ( NS ) MỘT NS của 7 là trung tính. Giảm NS dưới 7 cho thấy sự gia tăng tính axit (ion hydro), trong khi sự gia tăng NS trên 7 cho thấy sự gia tăng độ kiềm (các ion hydroxyl). Mỗi đơn vị pH đại diện cho sự thay đổi gấp 10 lần trong nồng độ.
Đề xuất:
Cấu trúc của cacbon có liên quan như thế nào đến sự đa dạng của các đại phân tử được tìm thấy trong cơ thể sống?
Nguyên tử cacbon có những đặc tính độc đáo cho phép nó tạo liên kết cộng hóa trị với nhiều nhất là bốn nguyên tử khác nhau, làm cho nguyên tố đa năng này trở nên lý tưởng để đóng vai trò là thành phần cấu trúc cơ bản, hay “xương sống” của các đại phân tử
Thế năng và động năng liên quan đến tàu lượn như thế nào?

Nói cách khác, tổng năng lượng không đổi. Trên tàu lượn siêu tốc, năng lượng thay đổi từ thế năng thành động năng và ngược lại nhiều lần trong quá trình đi tàu. Động năng là năng lượng mà một vật có được do chuyển động của nó. Năng lượng tiềm tàng là năng lượng dự trữ chưa được giải phóng
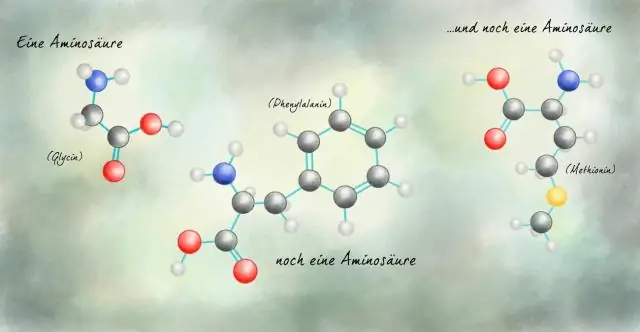
Làm thế nào các hợp chất hữu cơ có được tên của chúng Làm thế nào mà từ liên quan đến ý nghĩa của nó?
Làm thế nào là từ liên quan đến ý nghĩa của nó? Hợp chất hữu cơ được đặt tên từ số lượng liên kết cacbon. Từ liên quan đến nghĩa vì nó liên quan đến liên kết trong nguyên tử cacbon trong hợp chất hữu cơ
DNA trông như thế nào có liên quan gì đến cấu trúc hóa học của nó với cách nó trông như thế nào khi rất nhiều DNA tụ lại với nhau?

Liên hệ cấu trúc hóa học của nó với hình dạng của nó khi nhiều chất kết dính lại với nhau. DNA trông giống như mạng nhện. DNA hòa tan trong bộ đệm chiết xuất DNA nên chúng tôi không thể nhìn thấy nó. Khi nó được khuấy vào etanol, nó kết tụ lại với nhau và tạo thành các sợi dày hơn và dày hơn, đủ lớn để nhìn thấy
Điện thế có liên quan như thế nào đến điện trường?

Điện thế chỉ đơn giản là công được thực hiện trên một đơn vị điện tích để di chuyển nó từ thế này sang thế khác trong điện trường. Sự khác biệt giữa hai đẳng thế khác nhau là hiệu điện thế hoặc hiệu điện thế. Điện trường mô tả lực tác dụng lên một điện tích
